Министерство здравоохранения подготовило проект «Об утверждении порядка и условий предоставления медицинских документов (копий) и выписок из них». Этот документ устанавливает правила и условия выдачи медицинских документов, содержащих информацию о пациенте или состоянии его здоровья, законному представителю. Этот документ также полезен для тех, кто хочет стать директором медицинской организациипройти профессиональную переподготовку или переобучение по медицинской специальности
Согласно статье 38 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации» от 21.21.201011 N 323-ФЗ, Правительство Российской Федерации по обращению медицинской техники, зарегистрированной в установленном им порядке, является уполномоченным им федеральным органом исполнительной власти и уполномоченным на территории Российской Федерации.
Регистрация медицинских изделий (МИ) — это государственный процесс, направленный на то, чтобы на рынке присутствовали только качественные, эффективные и безопасные изделия. Свидетельство о регистрации (СР) — это документ, подтверждающий соответствие МИ установленным требованиям и подтверждающий факт регистрации в России. РИ является необходимым документом для движения на рынке. Иными словами, регистрация МИС является обязательным условием для ее внедрения, использования, продажи и производства на территории Российской Федерации.
Федеральная служба по надзору в сфере здравоохранения Российской Федерации (Росздравнадзор) осуществляет регистрацию МИ на территории Российской Федерации. В процессе государственной регистрации Росздравнадзор направляет регистрационное досье МИ в одну из вторичных организаций и просит провести оценку досье экспертом, обладающим знаниями в области качества, безопасности и эффективности.
ООО «ССМК» готовит регистрационное досье (РД) в соответствии с требованиями законодательства и правилами регистрации.
В настоящее время регистрация медицинских изделий, предназначенных для распространения на территории Российской Федерации, также может осуществляться в соответствии с.
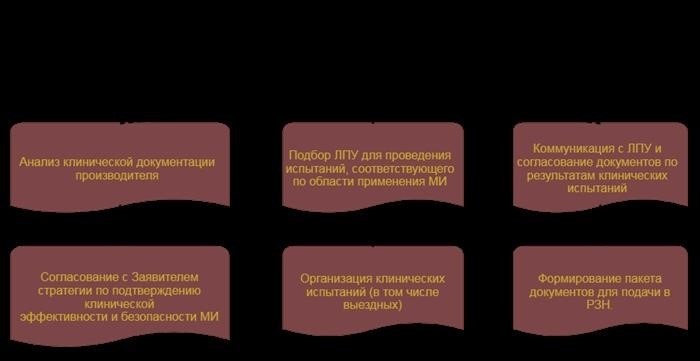
Процесс подготовки регистрационного досье на медицинское изделие (комплект документов, необходимых для регистрации медицинского изделия)

Срок получения свидетельства о регистрации медицинского изделия
Срок подготовки регистрационного досье зависит от категории риска МИ, выбранной системы регистрации МИ, требуемой области проверки и объема документации, которую необходимо подготовить. Поскольку отдельные этапы процесса выполняются, насколько это возможно, параллельно, регистрация изделия может быть завершена в очень короткие сроки, что позволяет сэкономить время. Срок подготовки регистрационного досье составляет не более 1,5 месяцев, а все необходимые документы, информация и образцы предоставляются незамедлительно. Средний срок подготовки регистрационного досье составляет 3-4 месяца.
Условия проверки регистрационных досье в РЗН:.
Документы, необходимые для регистрации медицинских изделий
Для подготовки регистрационного досье (комплект документов, необходимых для регистрации медицинского изделия) требуются следующие документы
Для изделий отечественного производства:
Для изделий, произведенных за рубежом:
В зависимости от сложности, категории риска и функциональных характеристик медицинского изделия список документов может меняться.
При положительном результате Федеральное агентство выдает регистрационное удостоверение и приложения к нему.
Мы управляем всеми этапами исследования проекта и оказываем профессиональную помощь в подготовке досье, снятии заключений и подготовке логичных ответов на запросы об экспертных услугах.
Отправьте нам запрос, и мы вышлем вам копию списка всех необходимых документов. Наши специалисты по листингу проанализируют имеющиеся у вас данные, выберут наиболее подходящий алгоритм листинга, оценят объем работ по подготовке документов и направят вам коммерческое предложение на выполнение работ по подготовке документов.
Какие документы необходимы для регистрации медицинского изделия?
Согласно законодательству, на российском рынке могут свободно продаваться только медицинские изделия, прошедшие обязательную государственную регистрацию (Федеральный закон N 323-ФЗ от 21 ноября 2011 года, статья 38). Факт действия подтверждается выдачей регистрационного удостоверения (РК). Как получить.
Согласно закону, на российском рынке могут свободно продаваться только медицинские изделия, прошедшие обязательную государственную регистрацию (Федеральный закон N 323-ФЗ от 21 ноября 2011 года, статья 38). Факт реализации подтверждается выдачей регистрационного удостоверения (РК). Для его получения заявителю необходимо пройти сложный многоступенчатый процесс.
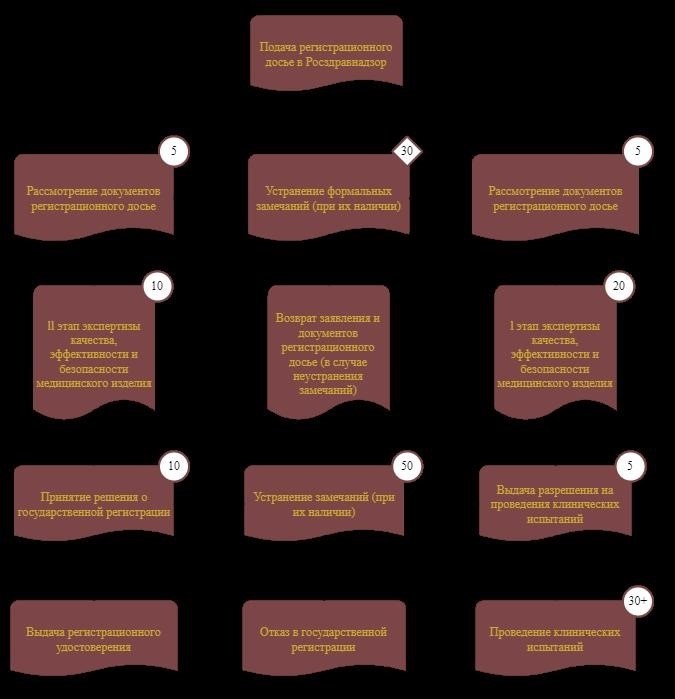
Как устроен процесс государственной регистрации?
Рассмотрением заявок и свидетельств о регистрации в нашей стране занимается Росздравнадзор. Алгоритм государственной регистрации может несколько отличаться в зависимости от категории потенциального риска применения, к которой относится регистрируемое медицинское изделие.
Однако для большинства изделий краткое описание этого процесса выглядит следующим образом.
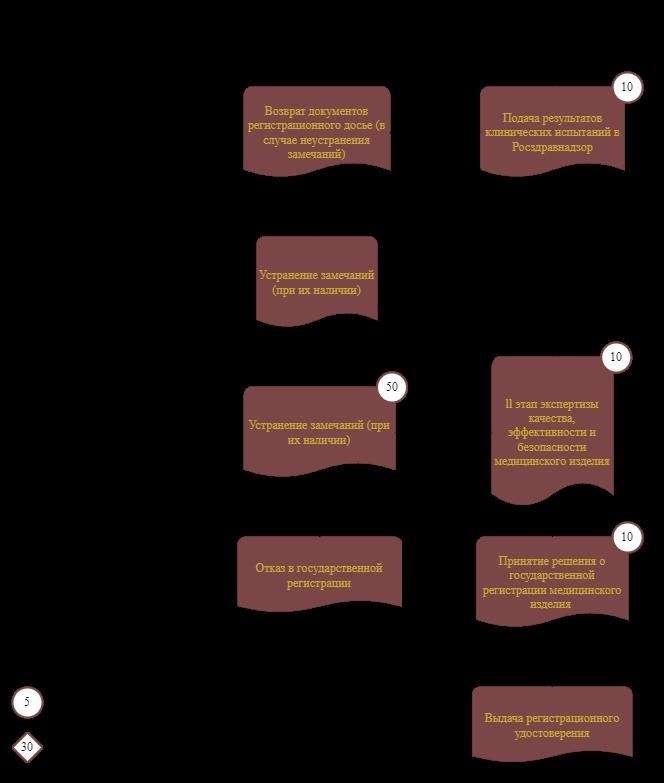
Исключения — изделия, относящиеся к категории потенциального использования «риск 1», то есть с наименьшим риском для пациентов. Они проходят клинические испытания еще до начала регистрации, то есть на этапе составления регистрационного досье. Благодаря этому они не проходят экспертную оценку и клинические испытания первой фазы. Изучив регистрационное досье, Росздравнадзор планирует в ближайшее время провести II фазу экспертных испытаний.
В любом случае, общая продолжительность процесса регистрации не должна превышать 50 рабочих дней. Однако в этот срок не входит продолжительность клинических испытаний. Клинические испытания могут длиться по-разному, в зависимости от сложности и потенциальных рисков, связанных с предполагаемым использованием медицинского изделия.
Заявки на внесение в государственный перечень
Основанием для начала процесса регистрации является получение Росздравнадзором от заявителя, желающего его получить. Свободная форма этой пенсии не предполагается. Состав сведений, отражаемых в данном документе, регулируется единым пунктом 9 Указа № 1416. 1416. include:
Заявитель должен приложить к заявке перечень документов, подтверждающих соответствие представленной на регистрацию продукции установленным требованиям.
Регистрация медицинских изделий: каталог документов
Конфигурация пучка документов, подключенного к заявке, содержит следующую информацию.
Для некоторых видов продукции может потребоваться дополнительная документация.
Например, если изделие произведено за рубежом и официально ввезено в Россию для государственной регистрации, необходимо представить лицензию на ввоз изделия, выданную уполномоченным органом. В этом случае заявитель также должен представить документы, выданные в стране-производителе, подтверждающие качество, эффективность и безопасность самого медицинского изделия или компонентов, сырья, материалов и других предметов, использованных при его создании. Если эти документы составлены на иностранном языке, они должны быть переведены на русский.
Данный перечень документов является исчерпывающим. Регистрирующий орган не вправе требовать от заявителя предоставления других документов. Например, дневник использования медицинского оборудования. Если по каким-либо причинам процедура государственной регистрации прервана, документы, повторяющие регистрацию медицинского изделия, должны быть сконцентрированы в соответствии с оригинальным каталогом.